福島路生(アラスカ大学ジュノー校水産学部大学院)
「北海道・猿払川におけるイトウの産卵環境と生殖」(FGF研究成果報告、抜粋)
1993、2017/07/26
北海道の森と川を語る会会報「森と川」No.3/1993に収録された上記論文の一部を、著者の福島路生氏(現・環境庁国立環境研究所研究員)と「北海道の森と川を語る会」小野有五代表(北海道大学大学院地球環境研究科教授)のご許可を得て、抜粋・収録しました。福島・小野両氏に深く感謝いたします。(なお*印のついた図表は省略しました)
どんな魚か
イトウ(Hucho perryi Brevoort )は日本最大の淡水魚で、分類上はサケ科イトウ属に属する。ほかのサケ科の魚と比べ体高が低く、頭は小さく平坦である。また、背面は青みがかったオリーブ色をして頭部側面から体側部にかけて濃褐色の小点が散在する。腹面は白く、体側は銀白色であるがやや赤みを帯びているものもある。オスは産卵期にこの体側の赤みが強まり、鮮やかな朱色に染まる。(写真1および表紙写真参照)
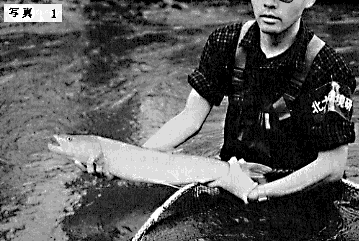 体長は1m以上、体重は25-45kgに達する(Berg、1962)とされるが、近年は生息域の縮少、資源量の減少とあいまって、とくに大型の個体を見かけることは極めてまれになりつつある。
体長は1m以上、体重は25-45kgに達する(Berg、1962)とされるが、近年は生息域の縮少、資源量の減少とあいまって、とくに大型の個体を見かけることは極めてまれになりつつある。
イトウ属はユーラシア大陸に広く分布し日本に生息するイトウHucho perryiの他にシベリヤに生息するタイメン(アムールイトウ)H.taimen、朝鮮半島の鴨緑江上流のコウライイトウ(チャチ)H.ishikawai、中国の揚子江上流の虎魚H.bleekeri、ヨーロッパのドナウ河のフーヘンH.huchoの4種が知られている。これらイトウ属の魚はよく似た形態をしているが、イトウ(Hucho perryi)の側線鱗数は100〜125で、他の4種の側線鱗数150〜200に比べて著しく少ないことから区別できる。イトウは主として北海道、南千島、樺太の河川、湖沼に分布するほか、過去に措いては青森県の小川原沼で捕獲されたこともある。日本以外ではウラジオストック・オリガ及びアマグ(沿海州)からの記録があるが、北千島・カムチャッカ半島以北からの報告はない。一般に平野をゆるやかに流れる河川に多く見られ、北海道では道北・道東の一部の河川に比較的多く生息している。また。本種はイトウ属の中で唯一降海するものであり、沿岸水域でも生息していると考えられている(木村1966)。
山代(1965)は、この魚についての研究はこれまで単に分類学的記録にとどまり、その生態に関する報告はないに等しい、と述べている。それから30年近く経った現在も状況はさほど変わらず、生態についてはわずか数編の論文が発表されているに過ぎない(例えば、本村、1966;Gritzenko et al,、1976;川村他、1983)。
イトウの生活史について、これまでにわかっていることをまとめると以下のようである。
イトウの年齢と成長との関係は道東の河川においては満1年で体長10cm、2年で15cm、5年で30cm、8年で50cm位、道北の河川では1年で10cm、2年で20 cm、5年で50cm、8年で70cm位とされ、各河川により差が見られるが、その成長度はサケ・マスの中では決してよい方とは言えない(山代、1988)。
イトウの卵は発眼までに積算温度200℃強、孵化までに350℃、浮上までに600℃を要し、仔魚は7月〜8月に浮上する。(川村洋司、北海道立水産孵化場、私信)。稚魚はその後1〜2年は上流域に生息し、主に水生昆虫を餌としていると考えられるが、その詳細については明らかにされていない。さらに成長し体長が30cmを越える頃になると食性は魚食性へ変化してフクドジョウなどの小魚を食べるようになり、生息域も下流へと変化してゆくと考えられる。イトウが初めて成熟する大きさは雄で体長45cm位、雌で55cm位で、シロザケのよぅに一生に一回の産卵で生命を終えるのではなく生涯に数回の産卵を繰り返す。 飼育されるイトウの成魚については毎年産卵することが確認されているが、天然のイトウの産卵については断片的なデータしかなく、毎年産卵しているのか、数年に一度しか産界しないのか、明らかになってはいない。イトウの産卵についてこれまで明らかにされていることを以下に簡単に紹介しておこう。タタール海峡(間宮海峡)に注ぐ沿海仰の河川では7月に産卵することが知られている(Berg、1962)。サハリン・ボガタヤ川では5月の終わりに河口で産卵後の個体を見かけるが、産卵期はその後6月下旬ごろまで続くようである。(Gritzenko et al.、1974)。北海道東部では河川の氷がとける3月中旬から4 月下旬の問に産卵すると推定されており(木村、1966)、緯度が低くなるに従って産卵期が早まる傾向が窺える。産卵個体群の年齢組織はサハリン・ボガタャ川で8+から16+、このうち最も頻度が高かったのは10+と11+である(Gritzenko et al.、1974)。北海道北部では比較的若齢の5+(メス)および3+(オス)で成熟し、という報告がある。(寺西哲夫、川村洋司、北海道水産孵化場、山内晧平、北海道大学水産学部、未発表)。またイトウの産卵環境に関する文献はわずかに木村(1966)と筆者によるFukushima(1990)があるのみである。しかも木村(1966)は北海道東部で発見された産卵床をわずか1例記載しているに過ぎない。
日本産サケ科魚類とは異なり春の4月下旬から5月にかけて行われ、親魚は雪解けによる増水時に下流域や湖から上流や支流の小河川に遡上して産卵する。産卵は河床が砂礫であり、川の淵から瀬に移行する部分で行われ、他のサケ・マス類同様に雌が産卵床を掘り、その中に産卵して砂礫をかぶせる。雌は一度に全部の卵を産卵するのではなく卵を数カ所に分けて産む。本種が生態的特徴について他のイトウ属とはっきり異なっている点は、イトウ属のなかで唯一降海することにある。本調査でも、沿岸の定置網にイトウが漁獲されたという報告を得ることができたので、イトウがその生活史のある時期を沿岸で過ごしていることはまちがいないであろう。しかし、イトウが1年を通じてどんな場所にいるのか、どこで越冬しているのか、わからないことはまだ無数にある。イトウはやはり最も謎に満ちたサケ科魚類なのである。
総合考察
1.イトウの産卵環境
Fukushima(1990)は猿払川支流狩別川で72個のイトウ産卵床を観察し、それらの立地条件が瀬と淵による河川の微地形と密接に関係していることを明かにした。個々の産卵床は必ず瀬頭(あるいは淵尻とも表現できる)の流れの方向に水深が徐々に浅くなり、水面が波立ちはじめる間際の部分につくられる(写真 12)。この部分は河床の縦断面で見ると淵―瀬という凹凸の凸の部の頂点に相当する。この部分に産卵する魚種はイトウに限らずニジマス Oncorrynchus mykiss(Needham & Taft、1934)、大西洋サケ(white、1942)、ブラウントラウト(Stuart、1954)、ベニザケ(Hoops、1972)、サクラマス(丸山、1981) マスノスケ 0. tshawytscha(Vronskii& Leman、1991)、そしてヨーロッパフーヘン(Holcik et al.、1988)など他の多くのサケ科魚類で知られている。さらにサケ科魚類以外でもヤツメウナギ(カワヤツメ、スナヤツメともに)がイトウとほぼ同じようなところに産卵することは前に述べた。
このように瀬頭の部分が多くのサケ科を中心とした淡水魚の産卵に利用される理由はこの部分の河床中に最も豊富な河川浸水が流れているからと一般に解釈されている(Stuart、1953;Vaux、1962)。産卵床中に浸透する河川水は卵と仔魚に酸素を供給し、また死んでバクテリアに分解されたものやその他の老廃物などをエッグポケットの外部へと排出する機能を持つ(Wells&McNeil、1970)。産卵床中の容存酸素が欠乏すると卵と仔魚の発達、成長は停滞し奇形魚を生じたり死亡率を高める(McNeil、1969)。河川水は瀬頭で河床礫中に漫透したあとその下流の淵頭の部分で再び河床から漫出し河川水と混ざる。Vaux(1962)はこのような河床礫間を流れる水の濃厚が河床断面の形状によって決定されることを流体力学的に説明した。
 次に産卵場におけるカバーの役割について検討してみたい。猿払川のイトウ産卵床の多くは水面上にササ(クマイザサ)が覆い被さる薄暗い場所につくられていた(写真13)。産卵期のオスは鮮やかな紅色の婚姻色が胸ビレの後方あたりから尾ピレまで一面に現れかなり遠方からでも認識できるほど目立つ(表紙写真参照)。メスは体を横倒しにして産卵床を掘る瞬間銀白色な体がギラギラと輝きこれも一目で存在が分かる。しかもメスは堀り行動に、オスは求愛行動と他のオスを追い払うことに熱中しているために警戒一心が薄くかなり近くに近づいても気づかれることはなかった。このことは人目につきやすいと同時にヒグマ、カワウソ、エゾクロテンなどの肉食哺乳動物に狙われやすいことも意味する(かつては北海道をはじめ日本全国に生息していたニホンカワソは現在では四国の一部に生息の可能性が知られているだけである。猿払川流域はカワウソにかわってミンクが多数生息している)。ササはちようどイトウの産卵が終わる5月初旬ぐらいまで積雪の下に倒されたササが水面にはり出し産卵行動中のイトウに格好なカバーを提供している(写真14)。この柔軟性に富む植物は5月中旬ごろ気温の上昇で融雪が進むと一勢に立ち上がる。それと同時にそれまで隠されていた川面に日光がさし込み河川水の水温は急上昇する。
次に産卵場におけるカバーの役割について検討してみたい。猿払川のイトウ産卵床の多くは水面上にササ(クマイザサ)が覆い被さる薄暗い場所につくられていた(写真13)。産卵期のオスは鮮やかな紅色の婚姻色が胸ビレの後方あたりから尾ピレまで一面に現れかなり遠方からでも認識できるほど目立つ(表紙写真参照)。メスは体を横倒しにして産卵床を掘る瞬間銀白色な体がギラギラと輝きこれも一目で存在が分かる。しかもメスは堀り行動に、オスは求愛行動と他のオスを追い払うことに熱中しているために警戒一心が薄くかなり近くに近づいても気づかれることはなかった。このことは人目につきやすいと同時にヒグマ、カワウソ、エゾクロテンなどの肉食哺乳動物に狙われやすいことも意味する(かつては北海道をはじめ日本全国に生息していたニホンカワソは現在では四国の一部に生息の可能性が知られているだけである。猿払川流域はカワウソにかわってミンクが多数生息している)。ササはちようどイトウの産卵が終わる5月初旬ぐらいまで積雪の下に倒されたササが水面にはり出し産卵行動中のイトウに格好なカバーを提供している(写真14)。この柔軟性に富む植物は5月中旬ごろ気温の上昇で融雪が進むと一勢に立ち上がる。それと同時にそれまで隠されていた川面に日光がさし込み河川水の水温は急上昇する。
 こうして礫の中に埋められたイトウの卵は急テンポで発達し、5月下旬にはほぼ発限を終え6月初旬には孵化するが卵黄を吸収するまでしばらく産卵床内に留まる。7月下旬ごろまでにはほとんど礫から浮上しているようで、このころ産卵場付近の浅場で流下してくる餌や河床に堆積した有機物を補食する姿が見られる。
こうして礫の中に埋められたイトウの卵は急テンポで発達し、5月下旬にはほぼ発限を終え6月初旬には孵化するが卵黄を吸収するまでしばらく産卵床内に留まる。7月下旬ごろまでにはほとんど礫から浮上しているようで、このころ産卵場付近の浅場で流下してくる餌や河床に堆積した有機物を補食する姿が見られる。
ササをはじめ河畔の植物は明らかにイトウの産卵親魚を外敵から守る働きがあるように見受けられるが、はたしてイトウがそのような場所を意識的に選択し産卵しているのかどうかは今のところ判然としない。というのは調査された河川はいずれも河畔にササが密生しいとるところで川面が覆い隠されていたからである。
イトウがカバーを選択したかどうかを調べるにはイトウの産卵可能な空間のうち何割がカバーを持っていたかということと、実際に産卵床がつくられた場所の何割にカバーが存在していたかを比較し出来ればいくつかの河川で統計的な評価を行なう必要があろう。
2.産卵床の分散 ―その1―
前章*で1匹のメスのイトウが1産卵期間中に場所を違えて複数ケ所に分散して産卵したと示唆されることを書いた。これは1産卵床あたりのエ0ッグポケットの数が1個から2個と極めて少ないこと(図5*)、日々の産卵床分布がB沢において流量の変動に応じて変移していること(図7*)、また産卵後に産卵床を守るメスの姿が全く見られなかったことなどの観察に基づいている。メスの親魚のサイズは1991年にわずか2尾計測されただけであるが、産卵行動中のものの目測などをふくめても60〜70cmのものが最も多く見られた。このサイズのイトウは約3000粒の抱卵数を持つことが知られているが(川村、1989a)、そのすべての卵をわずか2回の産卵で産み終えてしまうとは考えられない。川村(1989a・b)は北海道の別の水系のイトウについて、メスは5〜6回に分けて産卵するが1ケ所に連続して産むことは稀で、場所を変えて2〜3ケ所に産むことが多い、と述べている。
他のサケ科魚類の産卵行動に関する文献の中には1匹のメスが1産卵期間中、何カ所に産卵床をつくり、各産卵床あたりいくつのエッグポケットが存在するか(つまりその場所で何回産卵したか)について記載したものもいくつかあり、それらを以下に紹介しイトウとの比較を行ってみたい。
Bagliniere et al.(1990)は遡上中の大西洋サケ6尾にラジオ発信器を装着しその行動を追跡した結果、4尾は1ケ所のみに産卵し、他の2尾は2ケ所に産卵床をつくった後に下流へ下っていることをつきとめた。また1産卵床あたりのエッグポケットは3個から4個という観察がある(Hutchings & Hyers、1988)。しかしCrisp&Carling(1989)は大西洋サケとブラウントラウトの産卵を数多く観察し、1匹のメスは一般的に産卵床をひとつしかつくらないと述べている。同様にElliott(1984)はブラウントラウトは、決して1ケ所以上に産卵床をつくることはなかったと述べており、1産卵床あたりには複数個(Grost et al.1991)あるいは2個から5個(Elliott、1984)のエッグポケットが数えられている。Maekawa&Hino(1990)は11尾のメスのミヤペイワナの産卵行動と産卵床を観察し、平均で1産卵床あたりに2.2個のエッグポケットを数えている。さらにこれら11尾のメスは場所を変えて産卵床をつくることはなかった。Needham&Taft(1934)はニジマスの産卵床について6個から7個のエッグポケットが掘られたと推定している。Hawke(1978)はマスノスケの産卵床を7個調査し、エッグポケットを4個から6個認めた、Hawkeはこれらのエッグポケットをすべて掘り返し卵を残らず拝集した結果、1産卵床中に産み落とされた卵の数の合計がメスの平均抱卵数にほぼ匹敵することを明らかにした。このことからマスノスケは2ケ所以上に産卵床をつくることはないだろうと結論している。マスノスケをはじめサケ科サケ属魚類はニジマスなどを除いて産卵後も死ぬまで産卵床付近に居残り、同じ場所に産卵床を掘ろうとする他のメスを激しく攻撃する(Burner、1951;Briggs、1953)。またサケ属魚類の産卵床は一般に少なくとも2個、通常3個以上のエッグポケットを持つことが知られている(Mathisen、1962;Godfrey、1965;Smirnov、1975;Healey、1991)。したがって彼らが2ケ所以上に分散して産卵床をつくるとは考えにくい。
以上のように、イトウ属以外の多くのサケ科魚類は一般に1ケ所だけに比較的数多く産卵し、場所を変えてまた新たに産卵することは極めて少ないといえる。ではイトウやフーヘンなどイトウ属魚類のみに見られる産卵床の分散という行動はどのような生態学的な意味を持つのだろうか。
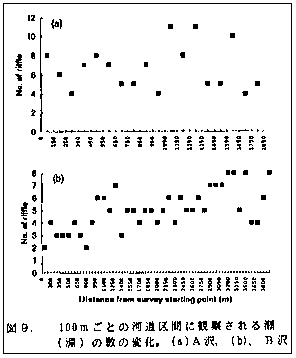 まずはじめにイトウの産卵の特徴として、その産卵密度が際だって低いことに注目してみよう。表1*、2*および6*に示されるように産卵床の分布密度は1991、1992年で最も高かったA沢(1992年)でも100mあたりに平均でわずか3(2.92)個足らずであった。しかもこれは約2週間の産卵期の合計値だから、実際は100m区間に3匹ものメスのイトウが同時に産卵を行っていたとは考えられない。よって堀り行動中のメスは他のメスと産卵場所をめぐって競い合うこともなく、望むところに産卵床をつくり、場所を変えてまた産卵することも容易に行えたはずである。前述したように、イトウは決って瀬頭の限られた空間に産卵する。そこでイトウの産卵密度が単に河川長によって決定されるのではなく、単位河川長あたりの瀬(あるいは淵)の数によって決まると仮定してみよう。図9にA沢とB沢の調査区域で観察された瀬(あるいは淵)を100mごとに数えた結果を示した。A沢は下流から上流まで比較的多くの瀬―淵によって、区切られ、平均で約7個/100mの瀬が存在する。一方B沢では調査区域が長いこともあって下流から上流に向かうに従い瀬一淵の数が増えていく傾向が見られた。しかし平均すると約5個/100mの瀬が存在したことになる。したがってA沢(産卵床密度 2.92個/100m)にしてもB沢(同2・43個/100
m)にしても、産卵可能な空間(瀬頭)の約半分までしか利用されていなかったことが分かる。
まずはじめにイトウの産卵の特徴として、その産卵密度が際だって低いことに注目してみよう。表1*、2*および6*に示されるように産卵床の分布密度は1991、1992年で最も高かったA沢(1992年)でも100mあたりに平均でわずか3(2.92)個足らずであった。しかもこれは約2週間の産卵期の合計値だから、実際は100m区間に3匹ものメスのイトウが同時に産卵を行っていたとは考えられない。よって堀り行動中のメスは他のメスと産卵場所をめぐって競い合うこともなく、望むところに産卵床をつくり、場所を変えてまた産卵することも容易に行えたはずである。前述したように、イトウは決って瀬頭の限られた空間に産卵する。そこでイトウの産卵密度が単に河川長によって決定されるのではなく、単位河川長あたりの瀬(あるいは淵)の数によって決まると仮定してみよう。図9にA沢とB沢の調査区域で観察された瀬(あるいは淵)を100mごとに数えた結果を示した。A沢は下流から上流まで比較的多くの瀬―淵によって、区切られ、平均で約7個/100mの瀬が存在する。一方B沢では調査区域が長いこともあって下流から上流に向かうに従い瀬一淵の数が増えていく傾向が見られた。しかし平均すると約5個/100mの瀬が存在したことになる。したがってA沢(産卵床密度 2.92個/100m)にしてもB沢(同2・43個/100
m)にしても、産卵可能な空間(瀬頭)の約半分までしか利用されていなかったことが分かる。
ドナウ川に生息ずるフーヘンについても同様に産卵床密度が低いことが観察されている。HoIcik et al.(1988)は、産卵床はお互いに10m以上隔たってつくられるため、メス同士の産卵の妨害あるいは攻撃はなく、いくつかの観察結果からフーヘンの産卵床は平均で70〜75m間隔でつくられると述べている。しかしフーヘンの場合、人為的な影響でその生息数が生息域とともに近年急激に減少しており恐らく以前はもっと高密度に産卵されていたのだろうとも述べられている。
北海道およびサハリンのイトウに関しても近年の生息数・生息域の減少は何人かの研究者によって指摘されてきた(例えば木村、1966;Gritzenko et al.、1974)。しかしながらイトウの資源量に関する定量的なデータは皆無であり、猿払川のイトウについても、その個体群動態はまるでわかっていない。減少しているというのは、ほとんどそのすべてが釣人や漁師による情報でしかない。たとえ猿払川のイトウが過去に比べ人為的な影響(例えば河川開発・農地開発・釣り人口の増加など)で減少しているとしても、そのこととイトウの産卵床分散行動とは別な次元の現象である。つまり、産卵床を複数つくってもメス同士の干渉が少ない程度に、もともとイトウの生息数はあまり多くはなかったと解釈するべきなのである。
さて、イトウにとって何ケ所かの瀬頭に産卵床を分散してつくることが比較的容易であるということはこれで理解できたが、はたしてそうすることによって得られる利益はあるのだろうか。川村(1989b)はそれに対する解答を稚魚期の生存率を高めるための繁殖戦略だとする見解をとっている。すなわち川村は親魚の産卵行動観察からさらに産卵床浮出後の稚魚の捕食および流下行動までも調べた結果次のように結論している。
「(イトウの稚魚にとって)他の個体よりも少しでも早く流下分散して定着し、ナワバリを先に確保することがその後の生き残りにとって決定的に重要だと考えられる…(中略)…すこしでも早く分散定着し、しかも自分の子供同士の争いを少しでも少なくするために親である雌のイトウは…(中略)…一ケ所に全部産卵せずに、何ケ所かに分散して産卵する」と。
この説はイトウの産卵行動だけについて考えるならば十分に納得のいくものかもしれない。しかし他の多くのサケ科魚類に同じような産卵行動がほとんど見られないのは何故か。産卵床から浮上後河川内では餌をとらずに降海してしまうカラフトマスやシロザケは別としてもその他のサケ科魚類はすくなくとも稚魚期にはイトウと同じような河川生活期を送るのである。
どうもこの謎を解く前にもう一度イトウの産卵環境とイトウそのものについて分かっているデータを整理し検討してみる必要がありそうだ。
3.産卵床の分散 ―その2-
イトウの産卵場所がいずれも河川の最上流域、すなわち水流次数でいえば1 次あるいは2次水路にのみ見られるのは、猿払川だけに限らずおそらく他のイトウの生息が知られる河川にも共通する現象であろう。フーヘンやシベリアに広く分布するタイメンの産卵河川も極めて規模が小さいことが知られており、Holcik et al(1988)によれば、“産卵場所は川帽2〜3m”あるいはまた“1 次〜2次水路”などという表現が使われている。これは、イトウの生息河川が比較的大河川で、それも河床勾配が緩く、中・下流域は湿地帯になっている河川がほとんどであるため、最上流域まで入らないとサケ科魚類の産卵に適した河床礫が得られないからであろう。河床勾配が緩いことは、猿払川でのイトウの産卵場所がいずれも海抜わずか50m付近に分布しているという事実からも想像できよう。また産卵場所の川幅はどの河川でも狭く、せいぜい3mから4mほどであった.河道は淵―瀬が小刻みに繰り返されA沢とB沢を例にとれば、100m区間に平均でそれぞれ7個と5個の瀬(淵)が存在する。仮に瀬と淵との長さを等しいものと仮定してみると各河川の産卵場における瀬の長さは平均でそれぞれ約7m、10mと計算されよう。
一方これらの瀬の瀬頭の部分につくられた産卵床のサイズは、エッグポケットが1個のもので約110cm、2個のもので約200cm、全体の平均では145cmであった。この産卵床サイズは意外なことにペニザケ(Mathisen,1962;McCart,1969)、カラフトマス(Smirnov,1975)、ギンザケ(Sandercock,1991)などで報告されているものにほぼ匹敵する。意外とのべたのはこれら太平洋サケの産卵床には通常3個以上ものエッグポケットが存在するからである。またイトウの親魚についてはメスの体長がおよそ60〜70cmでありその抱卵数が約3000粒であると推定されるがこちらもまた太平洋サケ(とくにシロザケ・ペニザケ・ギンザケ)のものと大差がない。太平洋サケの産卵河川規模について触れていなかったが、ギンザケがイトウのように川帽の比較的狭い最上域でも産卵することが知られる程度で他の魚種は一般的にイトウよりもはるかに大きな河川の中・下流域で産卵する。
イトウの産卵の特徴を、産卵床をひとつしかつくらない魚の代表として太平洋サケと比較してみたが、これらの事実を総合的に解釈すれば次のようなことが言えるのではなかろうか。つまり、イトウはその魚体、抱卵数、そして産卵床のサイズに比較して産卵場の河川規模、特に産卵可能な瀬頭のスペースがあまりにも小さすぎる、と。狭い空間につくられた産卵床はエッグポケットが2個掘られた段階ですでにかなりの大きさに達しているために、3個目、4個日のエッグポケットを掘ること(すなわち1ケ所ですべての産卵を終えてしまうこと)は物理的に不可能な場合が多いのではあるまいか。エッグポケットが1個から2個に増えただけで平均1m近くも産卵床が長くなっているのである。たとえそれが物理的に可能であっても一ケ所に数多くのエッグポケットを掘ることが非常にリスクの大きなことであることを物語る研究がロシアで行われている。Vronskii&Leman(1991)はカムチャッカ川のマスノスケ産卵場において淵から瀬頭そして瀬の中央部へと2m間隔に、1000粒づづマスノスケ受精卵を河床礫の中に埋め、その後の卵とふ化仔魚の生存率を記録した。同時に彼らは礫中の水温・容存酸素濃度・河川水の浸透濃度およぴ静水圧など様々なパラメーターを一定間隔に計測した。その結果次のようなことが分かった。卵と仔魚の生存率は淵に埋められたものが最低で、瀬の中央部のものがそれに次ぎ、それらの境に位置する瀬頭で最高値を記録する。さらに容存酸素量と浸透水速度もともに瀬頭でピークに達し、上・下流方向に隔たるにしたがって急激に低下すること。
すなわちエッグポケットを数多く持った大きな産卵床を河川規模の小さい(淵―瀬の間隔が短い)産卵場につくることは、瀬頭からとおく隔たったところに産み落とされた卵を低浸透水量、低容存酸素量という悪条件にさらし、その生存率を下げるということに等しいのである。したがってイトウの産卵床分散行動についての筆者の結論は次のようになる。
彼らはその生息河川の特徴から中・下流域などに産卵に適した河床轢が存在しなかったため、はるか最上流の細流にまで遡上せざるを得なかった。そこでは産卵場所の河川規模が自らの体のサイズと比較してあまりにも小さいこと、そして産卵親魚の個体数が少ないことなどが作用し合い、イトウは1ケ所にすべて産卵せず、場所を違えて最も生産性の高い瀬頭にのみ小分けして卵を産むことを覚えたわけである。
イトウ産卵河川の流域保全
これまでの調査から明らかになったイトウの生態をもとに、その生息河川と流域の保全という問題について、猿払川で行われている様々な開発行為を例にとって考察したい。
まず、イトウに限らず猿払川のサケ科魚類が、河川内でスムーズに遡上・降下を行えているかという問題から話を進めよう。イトウの産卵場が猿払川の最上流、1次から2次水路を中心に分布していることは今まで繰り返し述べてきたとおりである。一方、季節的に最下流部の汽水域でイトウが日本全国から集まって来る釣人達をにぎわしていること、また、夏の間カラフトマス捕獲の目的で下流部に設置されるウライに毎年かなりな数のイトウが混獲されること、などの事実から察して、猿払川のイトウはその生活史においてすくなくとも汽水域(恐らくオホーツク海沿岸まで)から最上流域までほとんどの流程を生活の場としていることが分かる。
このことは彼らの河川内移動の妨げとなるような構造物(たとえばダムなど)の建設がサケ科魚類の存続に致命的な打撃を与えかねないということを示唆する。確かに北海道内にはイトウ生息河川に大規模な多目的ダムなどが建設された後でも、ダムとその流入河川との間で表面上なんの問題もなく再生産を繰り返している水系が存在する。これはダムの建設された位置が比較的下流部であったことと、その規模が十分に大きく、イトウの餌となる小魚とその生息環境がダムの上流側に十分残されたためであろう。イトウ達にとって幸いであったのは彼らの生息河川が一般に勾配の緩い丘陵地あるいは湿地帯を流れるためとミ、河川が氾濫することはあっても土砂災害の危険性が問題視されるようなことがなかったことだ。このため彼らの産卵場となる上流域に日本全国いたる所で見受ける治山ダム・防砂ダムが建設されなかった。また過去には猿払川の上流域にも取水用の堰堤がつくられることもあったが現在ではその目的で河道を遮断することは条例で規制されており堰堤に代わって河床に河川水を浸透させそれを取水するという方式がとられている。既存の取水堰壕も、幸い堤高が低いため、平水時には上流から下流への一方向の移動しかできないがイトウの遡上する融雪期の増水時には、彼らはかろうじてそれを乗り越えているようである。
 イトウの遡上障害が河川を遮断する堰堤やダム以外の人工構造物によっても引き起こされているという例を紹介しよう。猿払川の上流域は森林伐採のために古くからほとんどの川筋に治って林道が敷設されてきた。それらの林道が支流を横断する際、その支流が小河川(だいたい川幅3〜4m以下)であると工費の節約のためか、橋梁を設けず林道の下にカルパートと呼ばれるスチール製の管を埋め、その中に河川水を通すという工法がとられる。今まではこれらのカルパートが仕較的短かかった(長いものでも10mくらい)ことと、その断面形状が円形であったことのおかげでカルパートをイトウ達が通過してその上流の産卵場に到達することが可能であった。事実1991年に調査した19河川のうち5河川にカルパートが見られそのうち4河川の産卵場はカルパートの上流側に位置していた。ところが、ここ1、2年前から林道を舗装して道々に格上げする道路工事が着手されるようになり、それに伴い従来の円形のカルバートからボックスカルパートと呼ばれるコンクリートで4面張りにされたカルバートヘ付け換えられる箇所がでてきた(写真15)。このボックスカルバートであるが、イトウの遡上する増水時でも底が完全な平面で流れを乱す障害物がなにも無いために、水深が浅く、流れは一様で、しかも流速が極めて速い。筆者は猿払川のある1支流に設けられたボックスカルバートでその下流側にイトウの親魚が10匹ほど溜まっているのを偶然目撃したことがある。そのイトウ達はカルパート上流にある産卵場所を目指して何度も何度もカルパート内へ入り込んでは、水しぶきをあげて盛んに泳ぎきろうとするのだが、水深がわずか5cmたらずで流速が速い上に長さ25mのカルパート内には、1ケ所も魚が休息できるような場所がない。はじめは元気の良かったイトウも全流程の3分の2あたりまでくると力尽きて動きが止まりまた再び本の場所に流されてくるといった具合いである。しばらく観察を続けていたが1匹も上流側まで泳ぎきるイトウはいなかったし、その後この沢の上流を調査したが産卵床は一つも発見されなかった。このように河川を遮断した構造物でなくとも長さと断面形状しだいではカルパートがイトウをはじめ遡河性魚類の遡上を完全に不可能なものにしてしまいかねないことが判明した。
イトウの遡上障害が河川を遮断する堰堤やダム以外の人工構造物によっても引き起こされているという例を紹介しよう。猿払川の上流域は森林伐採のために古くからほとんどの川筋に治って林道が敷設されてきた。それらの林道が支流を横断する際、その支流が小河川(だいたい川幅3〜4m以下)であると工費の節約のためか、橋梁を設けず林道の下にカルパートと呼ばれるスチール製の管を埋め、その中に河川水を通すという工法がとられる。今まではこれらのカルパートが仕較的短かかった(長いものでも10mくらい)ことと、その断面形状が円形であったことのおかげでカルパートをイトウ達が通過してその上流の産卵場に到達することが可能であった。事実1991年に調査した19河川のうち5河川にカルパートが見られそのうち4河川の産卵場はカルパートの上流側に位置していた。ところが、ここ1、2年前から林道を舗装して道々に格上げする道路工事が着手されるようになり、それに伴い従来の円形のカルバートからボックスカルパートと呼ばれるコンクリートで4面張りにされたカルバートヘ付け換えられる箇所がでてきた(写真15)。このボックスカルバートであるが、イトウの遡上する増水時でも底が完全な平面で流れを乱す障害物がなにも無いために、水深が浅く、流れは一様で、しかも流速が極めて速い。筆者は猿払川のある1支流に設けられたボックスカルバートでその下流側にイトウの親魚が10匹ほど溜まっているのを偶然目撃したことがある。そのイトウ達はカルパート上流にある産卵場所を目指して何度も何度もカルパート内へ入り込んでは、水しぶきをあげて盛んに泳ぎきろうとするのだが、水深がわずか5cmたらずで流速が速い上に長さ25mのカルパート内には、1ケ所も魚が休息できるような場所がない。はじめは元気の良かったイトウも全流程の3分の2あたりまでくると力尽きて動きが止まりまた再び本の場所に流されてくるといった具合いである。しばらく観察を続けていたが1匹も上流側まで泳ぎきるイトウはいなかったし、その後この沢の上流を調査したが産卵床は一つも発見されなかった。このように河川を遮断した構造物でなくとも長さと断面形状しだいではカルパートがイトウをはじめ遡河性魚類の遡上を完全に不可能なものにしてしまいかねないことが判明した。
 また違う場所では建設中の道路の脇に河道の屈曲部が接近しているという理由で、その屈曲部がショートカットされ100m以上にわたって直線化されてしまったという河川がある(写真16)。その前年には同じ場所にいくつか産卵床がつくられていたが河道の流路が切り換えられたその年にはもちろん産射床はひとつもつくられなかった。しかし最も心配されたのはその直線河道が上流域の産卵場へ向かう親魚の遡上障害になりはしないかということであった。幸い河道掘削時にできた河床と河岸の凹みを休憩地点に利用しながら体長1m近くもあろうオスのイトウをはじめ何匹かのイトウがその直線部分を通過する姿が見られたし、その上流には数多くの産卵床がつくられたことがその後の調査で分かった。しかしもしこの直線河通がボックスカルパートのように徹底してコンクリートによって3面(あるいは2面)護岸されてしまっていたらどうなっていただろうか。実際その様な工法は数多くの河川で見受けられるのだ。
また違う場所では建設中の道路の脇に河道の屈曲部が接近しているという理由で、その屈曲部がショートカットされ100m以上にわたって直線化されてしまったという河川がある(写真16)。その前年には同じ場所にいくつか産卵床がつくられていたが河道の流路が切り換えられたその年にはもちろん産射床はひとつもつくられなかった。しかし最も心配されたのはその直線河道が上流域の産卵場へ向かう親魚の遡上障害になりはしないかということであった。幸い河道掘削時にできた河床と河岸の凹みを休憩地点に利用しながら体長1m近くもあろうオスのイトウをはじめ何匹かのイトウがその直線部分を通過する姿が見られたし、その上流には数多くの産卵床がつくられたことがその後の調査で分かった。しかしもしこの直線河通がボックスカルパートのように徹底してコンクリートによって3面(あるいは2面)護岸されてしまっていたらどうなっていただろうか。実際その様な工法は数多くの河川で見受けられるのだ。
このような例をひとつひとつ挙げ連ねて、イトウの産卵河川に一切手をつけるなと言っているのではない。肝心なことは、カルバートにしろ直線河道(捷水路)にしろ、その設計と工法の選択を間違えればその上流で毎年産卵を繰り返してきたイトウ、他のサケ・マス、そしてヤツメウナギさえも遡上することのできない川にしてしまいかねないということである。逆に言えば河川工事を担当する土木関係者そして河川管理者側にすこしでも河川に生息する生き物への配慮と知識が備わっていればちょっとした工夫で工費をむやみに嵩上げすることもなくこれらの河川構造物を魚たちにほとんど影響の少ない構造に変えることが可能だということだ。たとえば上記のボックスカルパートの場合これをこのまま放置しておけばこの支流を産卵場に利用していた個体群は数年後には絶滅してしまうだろう。しかしもしカルパート内部に魚が1時休憩できるような突起物を2ケ所にでもつくってやれば恐らく問題は容易に解決するだろう。
 河川内部で生じている問題はこの辺にして(実はまだいろいろあるのだが)河川外部つまり流域で起こっている主な問題を検討してみよう。猿払川に限らずイトウ生息河川の多くは中・下流部のなだらかな地形を利用して古くから森林を伐採しての牧草地化が進められてきた。また猿払川ではその上流、イトウの産卵場付近でもパルプを製産する目的で、森林伐採が国と民間企業によって行われている(写真17)。このように猿払川流域は極端に言えば丸裸の状態にされつつあり、それが単なる可能性ではなく現実的な話であることは、この地域の空中写真をみれば一目瞭然だし(写真2参照)、営林署発行の伐採計画事業図からも窺える。このままではイトウはおろか流域の生態系が破壊されてしまいかねないという危惧さえ持たれる。事実その生態系の頂点に立つであろうヒグマは以前この地域に数多く生息していたことが知られているが今ではその姿どころか足跡などの形跡さえもまるで見られない。イトウに関しては今のところ流域のこのような変化の影響は顕著に現れていないように思える。
河川内部で生じている問題はこの辺にして(実はまだいろいろあるのだが)河川外部つまり流域で起こっている主な問題を検討してみよう。猿払川に限らずイトウ生息河川の多くは中・下流部のなだらかな地形を利用して古くから森林を伐採しての牧草地化が進められてきた。また猿払川ではその上流、イトウの産卵場付近でもパルプを製産する目的で、森林伐採が国と民間企業によって行われている(写真17)。このように猿払川流域は極端に言えば丸裸の状態にされつつあり、それが単なる可能性ではなく現実的な話であることは、この地域の空中写真をみれば一目瞭然だし(写真2参照)、営林署発行の伐採計画事業図からも窺える。このままではイトウはおろか流域の生態系が破壊されてしまいかねないという危惧さえ持たれる。事実その生態系の頂点に立つであろうヒグマは以前この地域に数多く生息していたことが知られているが今ではその姿どころか足跡などの形跡さえもまるで見られない。イトウに関しては今のところ流域のこのような変化の影響は顕著に現れていないように思える。 しかし森林伐採のような大規模な環境破壊は河川を堰堤で分断するのとは訳が違い、テンポは遅いがより深刻で、取り返しのつかない結果を招きかねない。それが北海道に限らず日本全国の河川流域から得られた教訓である。一般的に言われていることからイトウヘの予測される影響を考えるならばまず植生の喪失に伴う保水能力の低下とそれによってひき起こされる問題が挙げられる。流域の保水能力が低下すれば降雨・降雪の滞留時間が短縮され春の融雪増水のタイミングは早まることが予想される。このことは増水のタイミングを上流の遡上と産卵のシグナルにしているイトウたちに誤った合図を送ることになるのだ。なぜなら流量変動パターンが変わるだけで、気温・水温などその他の環境条件はいまだイトウの産卵には適していないからだ。
しかし森林伐採のような大規模な環境破壊は河川を堰堤で分断するのとは訳が違い、テンポは遅いがより深刻で、取り返しのつかない結果を招きかねない。それが北海道に限らず日本全国の河川流域から得られた教訓である。一般的に言われていることからイトウヘの予測される影響を考えるならばまず植生の喪失に伴う保水能力の低下とそれによってひき起こされる問題が挙げられる。流域の保水能力が低下すれば降雨・降雪の滞留時間が短縮され春の融雪増水のタイミングは早まることが予想される。このことは増水のタイミングを上流の遡上と産卵のシグナルにしているイトウたちに誤った合図を送ることになるのだ。なぜなら流量変動パターンが変わるだけで、気温・水温などその他の環境条件はいまだイトウの産卵には適していないからだ。
 また植生を失った地表面では表面流出が相対的に増大する結果土壌の侵食が加速され河川へ大量な細流物質をもたらすことも考えられる。とくに猿払川流域では、森林伐採や林道整備のためにブルドーザーなどの重機が河川近くに入るため、大量の土砂が河川に流入している(写真18)。これらの物質がイトウの産卵床へ過度に堆積すれば産卵床内部で発育中の卵や仔魚への浸透水・容存酸素の供給が制限され高い死亡率を招くかもしれない。さらに、森林の樹冠による日光の遮蔽効果が失われることによって、流域が直射日光で暖められ河川水温が上昇する。冷水域を好むサケ科魚類へ与える影響は無視できない。
また植生を失った地表面では表面流出が相対的に増大する結果土壌の侵食が加速され河川へ大量な細流物質をもたらすことも考えられる。とくに猿払川流域では、森林伐採や林道整備のためにブルドーザーなどの重機が河川近くに入るため、大量の土砂が河川に流入している(写真18)。これらの物質がイトウの産卵床へ過度に堆積すれば産卵床内部で発育中の卵や仔魚への浸透水・容存酸素の供給が制限され高い死亡率を招くかもしれない。さらに、森林の樹冠による日光の遮蔽効果が失われることによって、流域が直射日光で暖められ河川水温が上昇する。冷水域を好むサケ科魚類へ与える影響は無視できない。
猿払川のイトウにとって再度不孝中の幸いであったのは、上流域の河畔林と川岸植生がほとんど手をつけられずに残されてきたことである。残されたと言えば聞こえはいいが現実には河畔にトドマツ・エゾマツなどの有用樹種が少ないためである。それに代わってハルニレ、ケヤマハンノキ、ヤナギ類などの樹林が生い繁り、下草にはアキタブキ、トクサ、そしてクマイザサが密生する。クマイザサが産卵時のイトウにカバーとして機能していることは前に示唆した。河畔林は直射日光をさえぎり水温の上昇を抑えたり、魚類の餌となる落下昆虫を供給したりという一般的に知られる効果以外にも様々な形で魚類を含め河川の生態系に関与している。
河床勾配が緩く、流域の土壌が未団結の堆積物から成る猿払川では特に春の増水時などに河道の側方侵食がさかんに行われる。その結果河岸の植物や河畔林はいたるところで穏元の部分が洗掘され、たとえばハルニレの大径木などにはかなり大きな淵が形成される。淵と瀬は常にペアで存在するために下流側には必ず瀬が出来る。樹木の根元がさらに侵食されれば最終的に河道内に倒木として供給されることになる。水中の倒木はサケ科魚類の好ましい生息環境を生み出す(Dolloff、1986;Elllott、1986;Losle,1986)。淵と瀬は河畔林とは無関係に河道が蛇行することによっても生じるがイトウの産卵床は不思議なことに河畔林あるいは倒木によって生みだされる淵―瀬の瀬頭につくられるケースが多い(Fukushima、1990)。
河川生態系の保全を考える上で河畔林を今ある状態のままに残してゆくことが最も優先されるべき課題であろう。また河畔林以外の森林についても、それが今のままのぺ一スで伐採され続けることには、流材の生態系を維持するといぅ観点からみれば大きな問題であり、伐採計画がもう一度見直される必要があることを主張したい。
引用文献
川村洋司(1989a) 気紛れな産卵生態の秘密、水の趣味、第6号、べースポールマガジン社
川村洋司(1989b) イトウ、山渓カラー名鑑・日本の淡水魚、93-99、川那部浩哉・水野信彦編集、山と渓谷社。
馬淵正袷、米川年三(1983) 道東の汽水湖・厚岸湖で漁獲されるイトウ、Hucho perryi(Brevoort)。北海道立水産孵化場研究報告、38、47-55。
木村清朗(1966) イトウ(8uchoperrui:BrevooRT)の生活史について。魚類学雑誌 14(1/3)、14-25。
高橋剛一郎・笹賀一郎(1985)渓間の氾濫原における土砂移動と流路変動。新砂防 38(4)、3-9。
丸山隆(1981)ヤマメSalmo(Oncorhynchus)masou masuo(Brevoort)とイワナSal.Vellnusleucomaenis(PALLAS)の比較生態学的研究Ⅰ、由良川上流における産卵床の形状と立地条件。日本生態学会誌31(3)、269-284。
山代昭三(1965) 北海道東北部におけるイトウ(Hucho perryi)の年令と成長。日本水産学会誌 31(1)、1-7。
Bagliniere, J. L., Maisse, G. a Nihouarn, A.(1990). Migratory and reproductive behaviour of female adult Atlantic salmon, Salmo salar L., in a spawning stream. Joulnal of Fish Biology 36, 511-520.
Banks, I. W. (1969). A review of the literature on the upstream migration of adult salmonids. Journal of Fish Biology i, 85-136.
Berg, L. S. (1962). Freshwater fishes of the U.S.S.A. and adjacent countries, Volume I, The Israel Program for Scientific Translations, Jerusalem.
Briggs, I. C. (1953). The behaviour and reproduction of salmonid fishes in a small coast stream. California Fish Game, Fisheries Bulletin 94, 62 pp.
Burner, C. J. (1951). Characteristics of the spawning nests of Columbia River salmon. U.S. Fish and Wildlife Service Fishery Bulletin 52, 97-ilo.
Campbell, J. S. (1977). Spawning characteristics of brown trout and sea trout Salmo tI,uttaL L. in Kirk Burn, River Tweed, Scotland. Journal of Fish Biology 11, 217-229.
Chebanov, N. A. (1980). Spawning behavior of the Pink salmon, Oncorhynchus gorbuscha, Journal of lchthyology 20, 64-73.
Crisp, D. T. a Carling, P. A. (1989). Observations on siting, dimensions and structure of salmonid redds. Journal of Fis;h Biology 34, 119-134.
Dolloff, C. A. (1986). Effects of stream cleaning on Juvenile cQho salmon and I)olly Varden in southeast Alaska. Transcations of the American Fisheries Society 115, 743-755.
Dutil, J. D. (1986). Energetic constraints and spawing interval in the anadromous Arctic char (Salvelinus alpinus). Copeia 1986(4), 9451955.
Elliott, I. M. (1984). Numerical changes and population regulation in young migratory trout Salmo trutta in a Lake District stream, 1966-83.
Elliott, S. T. (1986). Reduction of a Dolly Varden population and macrobenthos after removal of togging debris. Transactions of the American Fisheries Society 115, 392-400.
Fukushima, M. (1990). Spawing habitat of the Japanese huchen (Hucho perryi') in Karibetsu Creek, Hokkaido. Ms thesis, Hokkaido University, Japan.
Godfrey, H. (1965). Coho salmon in offshore waters. In Salmon of the North Pacofoc Ocean. Part IX. Coho, chinook and masu salmon in offshore waters, Int. North Pac. Fish. Comm. Bull. 16, pp. i-39.
Gritsenko, O. F., Malkin, E. M. a Churikov, A. A. (1974). Sakhalinskii taimen' ucho perr1'(Brevoort) reki Bogatoi(vostochnoe poberezh'e Sakhalina). Izv. TINTO 93, 91-100. (Japanese translation; In Sakana to Ran 143, 25-34, 1976.)
Grost, a. T., Hubert, W. A. a Wesche, T. A. (1991). Description of brown trout redds in a mountain stream. Transactions of the American Fisheries Society 120, 582-588.
Havke, S. P. (1978). Stranded redds of quinnaat salmon in the Mathias River, South lsalnd, New Zealand. New Zealand Journal of Marine and Freshwater Research 12, 167-171.
Healey, M. C. (1991). Life history of chinook salmon (Oncor.hynchus tshawytscha). In Pacific Salmon Life Histories (Groot, C a Margolis, L., ed.), pp. 313-383. UBC Press.
Helle, J. H. (1981). Significance of the stock concept in artifical propagation of salmonids in Alaska. Canadian Journal of Fisheries and Aquatic Sciences 38, 1665-1671.
Holcik, I., Hensel, K., Nieslanik, I. a Skacel, L. (1988). The Eurasian Huchen, Hucho hucho Largest Salmon of the World. Dr. W. Junk Publishers.
Hoopes, D. T. (1972). Selection of spawning sites by sockeye salmon in small streams. U. S. National Marine Fisheries Service Fishery Bulletin 70, 447-458.
Huntsman, A. G. (1948). Freshets and fish, Transactions of the American Fisheries Society 75, 257-266.
Hutchings, J. A. a Myers, a. A. (1988). Mating success of alternative maturation phenotypes in male Atlantic salmon, salmo salar. Oecologia 75, 169-174.
Jensen, A. I., Heggberget, T. G. & Johnsen, B. 0. (1986). Upstream migration of adult Atlantic salmon, Salmo salar L., in the River Vefsna, northerb Norway. Journal of Fish Biology 29, 459-465.
Jones, J. W. a King, G. M. (1949). Experimental observations on the spawning behavior of the Atlantic Salmon (Salmo salar. Linn.). Proc. Zool. Sic. 119, 33-48.
Lisle, T. E. (1982). Effects of aggradation and degradation on riffle-pool morphology in natural gravel channels, northwestern California. Water Resources Research 18, 1643-1651. . (1986). Effects of woody debris on anadromous salmonid habitat, Prince of Wales Island, southeast Alaska. North American Journal of Fisheries Management 6, 538-550.
Maekawa, K. (1985). Homing of lacustrine charT in a small lake with a few inlet creeks. Japanese Journal of lchthyology 32, 355-358.
Maekawa, K. a Hino, T. (1990). Spawning tactics of female miyabe charT (Salvelinus malma miyabei) against egg cannibalism. Canadian Journal of Zoology 68, 889-894.
Mathisen, O. A. (1962). The effect of alt.ered sex ratios on the spawning of red salmon. In Studies of Alaska Red Salmon (goo, T. S. Y., ed), pp. 137-246. University of Washington Publications in Fisheries. New Series, volume 1.
McCart, P. (1969). Digging behavior of Oncorhynchus nerka spawning n streams at Babine Lake,British Columbia. In Symposium on salmon and Trout in Streams (Northcote, T. G., ed.), H. R. McMillan Lectures in Fisheries, Uiversity of British Columbia, Vancouver, BC.
McCart, P. (1970). A Polymorphic population of OncoI.hynchus nerka at Babine Lake, B. C., involvinbO. anadromous (Sockeye)and nonlanadromous (kokanee) forms. Ph.D. thesis. University of British Columbia, Vancouver, BC.
McNeil, W. J. (1969). Survival of pink and chum salmon eggs and alevins. In Symposium of Salmon and Trout in Streams (Northcote, T. G., ed.), pp. 101-117. H. R. MacMi11an Lectures in Fisheries. University of British Columbia, Vancouver.
Needham, P. R. a Taft, A. C. (1934). Observations of the spawning of steelhead trout. Transactions of the American Fisheries Society 64, 332-338.
Ottaway, E. M., Carling, P. A. a Reader, N. A. (1981). Observations on the structure of brown trout, Salmo trutta Linnaeus, redds. Journal of Fish Biology 19, 593-607.
Phillips, R. B., Pleyte, K. A. a Brown, _M. R. (1992). Salmonid phylogeny inferred from ribosomal DNA restriction maps. Canadian Jour.nal of Fisheries and Aquatic Sciences 49, 2345-2353.
Sandercock, F. K. (1991). Life history of coho salmon (Oncorhynchus Kisutch). In Pacific Salmon Life Histories (Groot, C. a Margolie, L., ed.), pp. 397-445. UBC Press.
Smirnov, A. I. (1975). The biology, reproduction and development of the Pacific salmon. Izdatel'stvo Moskovskogo Uniyersiteta, Moscow (Translation Service No. 3861, Fisheries and Marine Service, Pacific Biological Sattion, Nanaimo, B. C. )
Stuart, T. A. (1953). Water currents through permeable gravels and their significance to spawning salmonids, etc. Nature 172, 407-408.
Vaux, W. G. (1962). Interchange of stream and lntragravel water in a salmon spawning riffle. U.S. Fish and Wildlife Service Special Scientific Report, Fisheries 405, 11 pp.
Vronskii, B. B. a Leman, V. N. (1991). Spawning stations, hydrological regime and survival of progeny in nests of chinook salmon, Oncorhynchus tshawytscha, in the Kamchatka River Basin. Journal of lchthyology 31, 91-102.
Wells, R. A. a McNeil, W. J. (1970). Effects of quality of the spawning bed on growth and development of pink salmonembryos and alevins. U.S. Fish and Wildlife Service Special Scientific Report, Fisheries 616, 5 pp.
White, H. C. (1942). Atlantic salmon redds and artificial spawning beds. Journal of Fisheries Research Board of Canada 6, 37-44.
